Vaskulitische Neuropathie
Einführung
Vaskulitische Neuropathien sind Erkrankungen des peripheren Nervensystems (PNS), bei denen es durch entzündliche Veränderungen der Blutgefäße (Vasa nervorum) zu einer Nervenschädigung kommt. Man unterscheidet isolierte Vaskulitiden des PNS (nichtsystemische vaskulitische Neuropathien, NSVN) und Neuropathien bei systemischen Vaskulitiden oder Kollagenosen. Vaskulitische Neuropathien können auch infektiös, parainfektiös oder paraneoplastisch auftreten.
Klinische Manifestation
Das Ausmaß und die Verteilung der vaskulitischen Veränderungen bestimmt das klinische Bild. Vaskulitische Neuropathien können sich als Mononeuropathia multiplex (10-15%), als Schwerpunktneuropathie (25-50%) oder als distal-symmetrische Polyneuropathie (PNP) manifestieren. Bei gründlicher Untersuchung kann die für die Vaskulitis typische Asymmetrie bei bis zu 90% der Betroffenen detektiert werden. Typisch sind akute bis subakute Paresen mit Sensibilitätsstörung und Schmerzen im Versorgungsgebiet peripherer Nerven; Dysästhesien fehlen in ca. 25 % der Fälle. Der Verlauf kann chronisch progredient oder schubförmig sein, in der Regel ohne Spontanremission. In den meisten Fällen liegt eine schmerzhafte sensomotorische, seltener eine überwiegend oder rein sensible Neuropathie vor. Die bei den NSVN am häufigsten betroffenen Nerven sind der N. peronäus, der N. tibialis und der N. ulnaris. Unspezifische Symptome wie Müdigkeit, Gewichtsverlust, Anorexie, Arthralgien und Fieber kommen bei bis zu 80 % der Patienten mit systemischer Vaskulitis vor und bei 50% der Patienten mit NSVN vor. Patienten mit primärer systemischer Vaskulitis (siehe Tabelle 1) zeigen häufig eine multiple Organbeteiligung (Niere, Lunge, Haut, Darm und zentrales Nervensystem). Bei den Kollagenosen gibt es jeweils typische Manifestationsformen (z. B. Engpass-Syndrome bei rheumatoider Arthritis, sensible Ganglionitis bei Morbus Sjögren).
Diagnostik
Neben umfangreicher Labordiagnostik, Liquordiagnostik (Tabelle 2) und elektrophysiologischen Untersuchungen wird zum Nachweis einer Vaskulitis die Biopsie eines sensiblen Nerven durchgeführt. In der Regel wird der N. suralis biopsiert; ist er ausgespart, wird ein anderer klinisch betroffener sensibler Nerv ausgewählt. Die zusätzliche, gleichzeitig durchgeführte Muskelbiopsie erhöht die Trefferquote einer Vaskulitis.
- Labordiagnostik: Es gibt keinen Labortest, der eine Vaskulitis definitiv nachweist oder ausschließt. Man erhält Hinweise für das Vorliegen einer systemischen Erkrankung, weiterer Organbeteiligung und erregerbedingter Erkrankungen (Tabelle 2). Bei den primären systemischen Vaskulitiden sind die Wegenersche Granulomatose (WG), die Mikroskopische Polyangiitis (MPA) und das Churg-Strauss-Syndrom (CSS) eng mit dem Vorkommen von antineutrophilen cytoplasmatischen Antikörpern (ANCA) assoziiert. ANCA können gegen Proteinase 3 (PR3, c-ANCA) gegen Myeloperoxidase (MPO, p-ANCA) oder andere Zielantigene gerichtet sein. Auch bei medikamentös induzierten Vaskulitiden wird das Vorkommen von p-ANCA beschrieben, dann in aller Regel MPO-ANCA. Bei Patienten mit WG werden überwiegend c-ANCA (anti-PR3-ANCA) nachgewiesen, die Spezifität ist fast 100%, die Sensitivität stadien- und aktivitätsabhängig. Beim CSS und der MPA finden sich häufiger p-ANCA/MPO-ANCA. Der Gruppe der ANCA-assoziierten Vaskulitiden sind die komplementverbrauchenden, viral oder durch Kollagenosen induzierten Vaskulitiden gegenüberzustellen. Hier kann die Bestimmung von Komplementfaktoren wie C3, C4 hilfreich sein. Die Vaskulitiden bei Kollagenosen können durch Nachweis von antinukleären Antikörpern (ANA), deren Differenzierung oder Bestimmung des Rheumafaktors (RF) genauer diagnostisch zugeordnet werden. Bei Verdacht auf (para)infektiöse Vaskulitis sollten Borrelien-, Cytomegalie-, HIV- und Hepatitis B/C- Titer in Serum und Liquor bestimmt werden, bei VZV-Verdacht PCR-Analyse im Liquor. Bei Hepatitis-B/C ist häufig eine Kryoglobulinämie nachweisbar, in aller Regel Typ II nach Bouet.
- Liquordiagnostik: Bei systemischer Vaskulitis ist der Liquor meist unauffällig. Bei Kollagenosen, vor allem beim systemischen Lupus erythematodes (SLE), können Pleozytose, intrathekale IgG-Synthese und/oder Eiweißerhöhungen vorkommen, beim CSS auch eine Eosinophilie. Wegweisend ist der Liquorbefund bei den (para)infektiösen Vaskulitiden, wo sich in der Regel eine Pleozytose mit Schrankenstörung finden lässt. Durch Vergleich mit entsprechenden Serumtitern kann der Nachweis einer intrathekalen Antikörpersynthese geführt werden.
- Elektrophysiologie: Die Elektroneurografie zeigt das Verteilungsmuster der beteiligten Nerven, kann die subklinische Beteiligung sensibler und motorischer Nerven aufdecken und hilft bei der Festlegung des zur Biopsie geeigneten Nerven. In der Elektromyografie sieht man das Ausmaß der axonalen Degeneration (Denervierung). Die motorischen und sensiblen Nerven weisen initial häufig eine noch normale oder im unteren Normbereich liegende Nervenleitgeschwindigkeit (NLG) auf bei deutlicher Amplitudenreduktion. Im Verlauf lässt sich häufig kein motorisches und sensibles Summenaktionspotential mehr ableiten, motorische Leitungsblöcke sind beschrieben.
- Nervenbiopsie: Der Nachweis von Gefäßentzündung und –nekrose durch die Biopsie ist die einzige Möglichkeit, die Diagnose einer Vaskulitis eindeutig zu stellen. Die Nervenbiopsie im gesamten Querschnitt ist sinnvoller als eine faszikuläre Biopsie, da der inflammatorische Prozess häufig fokal und segmental abläuft. Eine adäquate Aufarbeitung des Biopsiematerials inklusive Immunhistochemie zum Nachweis inflammatorischer Zellen und Differenzierung und Erstellung von Semidünnschnitten ist erforderlich. Morphologisch muss bei einer Vaskulitis eine Infiltration der Gefäßwand epineuraler Gefässe durch inflammatorische Zellen vorliegen. Eine alleinige perivaskuläre Zellinfiltration ohne Gefäßwandinfiltration reicht zur Diagnosesicherung nicht aus. In älteren Läsionen kann man Fibrin-Ablagerung und Gefäßokklusion mit sekundärer Rekanalisierung sehen. Der Nerv selbst zeigt einen unterschiedlichen Ausfall myelinierter Axone, häufig asymmetrisch verteilt zwischen den einzelnen Faszikeln. Abhängig vom Stadium der Erkrankung sieht man axonale Degeneration (Wallerian’sche Degeneration).
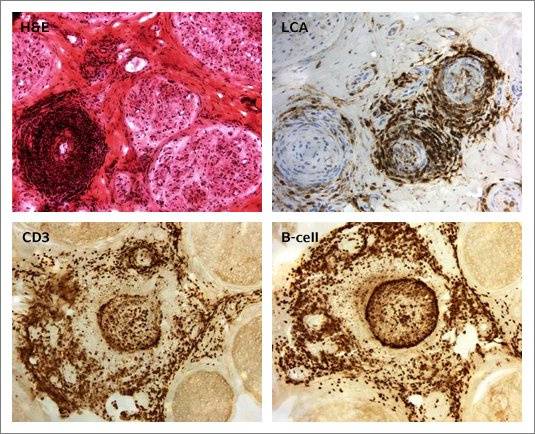
Vaskulitis im peripheren Nerv
Auch wenn die systemischen Vaskulitiden durch die Größe der betroffenen Gefäße klassifiziert werden, kann die Zuordnung zu einer bestimmten Erkrankung nicht isoliert durch den Biopsiebefund getroffen werden. Nur im Zusammenhang mit klinischen und Labordaten ist eine korrekte Einordnung des Biopsieergebnisses möglich. Je nach Erkrankungsstadium finden sich unterschiedliche morphologische Veränderungen von der akuten Entzündung bis hin zum geheilten oder vernarbten Gefäß. Eine negative Biopsie schließt eine Vaskulitis nicht aus, da diese fokal und segmental verteilt sein kann und das Bioptat nur einen Ausschnitt des Gefäßsystems repräsentiert.
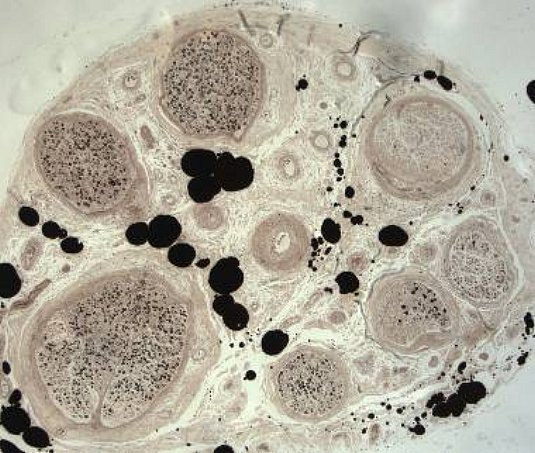
Semidünn-Schnitt (Phenyldiamin); Kunststoff-/Epon-Einbettung, Gesamter Nerven-Querschnitt. Deutlich sichtbar der unterschiedlich akzentuierte Ausfall der myelinierten Axone in den einzelnen Faszikeln, bis zum kompletten Verlust.
Einteilung der Vaskulitiden
Die nachfolgend aufgeführten Tabellen sind in den Leitlinien der Deutschen Gesellschaft für Neurologie (DGN) verankert.
| Primäre systemische Vaskulitiden | |
|---|---|
| Takayasu Arteriitis Riesenzellarteriitis |
Aorta und große Arterien |
| Polyarteriitis nodosa Kawasaki-Syndrom |
mittelgroße Arterien |
| Wegener-Granulomatose Churg-Strauss-Syndrom Mikroskopische Polyangiitis |
mittelgroße Arterien und kleine Gefäße ANCA-assoziiert |
| Henoch-Schönlein-Purpura Leukozytoklastische kutane Angiitis Kryoglobulinämische Vaskulitis |
kleine Gefäße |
| Sekundäre systemische Vaskulitiden | |
| Bei Kollagenosen | rheumatoide Arthritis Lupus erythematodes Sjögren-Syndrom Sklerodermie (selten) |
| Bei Infektionen | (para)infektiöse Vaskulitis (z. B. Lyme-Borreliose, CMV) chronische Hepatitiden (Hepatitis B/C) retrovirusassoziierte Vaskulitis |
| Bei malignen Erkrankungen | lymphoproliferative Erkrankungen, Karzinome |
| Medikamenteninduziert | Propylthiouracil, Hydralazine, PenicillamineThalidomid, Valcyclovir und Infliximab |
| Nichtsystemische Vaskulitiden | |
|
|
Laboruntersuchungen bei Verdacht auf vaskulitische PNP
(u.a. nach Kissel 2001)
| Allgemein | |
|---|---|
| Serum | Blutbild mit Differenzial-BB, BSG, CRP, Akutphase-Proteine, Serumelektrophorese, Immunfixation, Immunelektrophorese |
| Urin | U-Status, Eiweiß, Mikroalbumin, Glukose, Kreatinin-Clearance, Immunelektrophorese |
| Liquor | Zellzahl, Eiweiß, Glukose, oligoklonale Banden, Lactat |
| Primäre systemische Vaskulitiden | |
| PAN | Hepatitisserologie: HbsAg, Anti-Hbs |
| CSS | Eosinophilie, ANCA (50%), meist p-ANCA perinukleäre antizytoplasmatische Antikörper: Anti-Myeloperoxidase (MPO)-Ak, eosinophiles kationisches Protein (ECP) |
| MPA | ANCA (75%), meist p-ANCA perinukleäre antizytoplasmatische Antikörper: Anti-Myeloperoxidase (MPO)-Ak |
| WG | ANCA, meist c-ANCA zytoplasmatische antizytoplasmatische Antikörper: Anti-Proteinase 3 (PR-3)-Ak |
| Bei Kollagenosen | |
| Allgemein | ANA, ANA-Differenzierung |
| Systemischer Lupus erythematodes | anti-ds-DNS-Antikörper, Lupus-Antikoagulans, C3, C4-Komplement, Kryoglobuline, RNP-Ak |
| Primäres Sjögren-Syndrom | ANA, anti-SS-A (Ro), -SS-B (La), RF, Kryoglobuline |
| Sklerodermie | ANA, anti-Scl 70-Ak |
| Rheumatoide Arthritis | RF, CCP-AK, Kryoglobuline, anti-SS-A(Ro), -SS-B(La) |
| Mixed connective tissue disease | anti-RNP-Ak |
| (Para)infektiöse Vaskulitiden | |
| Hepatitis B, C, G | Virus-Serologie, (HepB)/ RNA quantitativ, Kryoglobuline |
| Retrovirus Infektion | Virus-Serologie, Kryoglobuline |
| CMV-Infektion | Virus-Serologie, inklusive Pp65/pp66 |
| Borreliose | ELISA, Immunoblot |
| Bei malignen Erkrankungen | |
| Bronchial-/Ovarial-/ Mammakarzinom, lymphoproliferative Erkrankungen | anti-neuronale Ak (anti-Hu, anti-Yo, anti-CV2, anti-Amphiphysin) |
| Medikamentös induzierte Vaskulitis | |
| Hydralazin, Penicillamin, Propylthiouracil | Assoziation mit p-ANCA/MPO-ANCA |
Häufigkeit der vaskulitisassoziierten Neuropathie
| Diagnose | Häufigkeit der assoziierten Neuropathie |
|---|---|
| Riesenzellarteriitis | 14% (Caselli et al. 1988) |
| Takayasu-Arteriitis | selten (Kissel u. Mendell 1992) |
| Polyarteriitis nodosa | 50-75% (Moore u. Cupps 1983, Olney 1992, Rosenbaum 2001) |
| Vaskulitis assoziiert mit Hepatitis B/C | 19% bei Hepatitis B (Said 1995) bis zu 50% bei Hepatitis C mit Kryoglobulinämie (Nemni et al. 2003) |
| Kawasaki-Syndrom | selten |
| Wegener-Granulomatose | 11-40% (de Groot et al. 2001, Nishino et al. 1993) |
| Churg-Strauss-Syndrom | 50-75% (Chumbley et al. 1977, Olney 1998, Rosenbaum 2001) |
| Mikroskopische Polyangiitis | 50-75% (Chumbley et al. 1977, Olney 1998, Rosenbaum 2001) |
| Schoenlein-Henoch-Purpura | nicht beschrieben |
| Essentielle kryoglobulinämische Vaskulitis | 7-60% (Garcia-Bragado et al. 1988, Gemignani et al. 1992) |
| Kutane leukozytoklastische Vaskulitis | nicht beschrieben |
| Rheumatoide Arthritis mit Vaskulitis | 1-21,5% (Chalk et al. 1993, Peyronnard et al. 1982, Said 1995) 40-75% (Cruickshank 1954, Scott et al. 1981) |
| Lupus erythematodes | 6-21% (Feinglass et al. 1976, Omdal et al. 1993) |
| Primäres Sjögren-Syndrom | 10-23% (Gemignani et al. 1994, Mauch et al. 1994, Mellgren et al. 1989, Molina et al. 1985) |
| Sklerodermie | 14% (Averbuch-Heller et al. 1992, Hietaharju et al. 1993) |
| HIV-Infektion | 2% (Fuller et al. 1993) |
| Lyme-Borreliose | 2% (Halperin et al. 1987, Meier et al. 1989, Schäfers et al. 2001) |
| Sarkoidose | selten (Said et al. 2002) |
Pathogenese
Durch eine gestörte Blut-Nerven-Schranke kommt es zur Infiltration inflammatorischer Zellen (T-Lymphozyten und Makrophagen) in die Vasa nervorum und die epineuralen Gefäße mit daraus resultierender Ischämie und axonaler Degeneration. Dieser Prozess wird induziert durch proinflammatorische Zytokine und Metalloproteinasen.
In hoher Anzahl zirkulierende proinflammatorische Zytokine sind assoziiert mit dem neuropathischen Schmerz.
Therapie
Die nachfolgend aufgeführten Therapien sind in den Leitlinien der Deutschen Gesellschaft für Neurologie (DGN) verankert.
Die primäre systemische Vaskulitis wird kombiniert immunsuppressiv behandelt mit einer hochdosierten Therapie zur Remissionsinduktion (Induktionstherapie), und zwar mit Glucocorticoiden, z. B. Methylprednisolon 1 mg/kg KG/d oder 500-1000 mg/d über 3-5 Tage als initiale intravenöse Pulstherapie plus Cyclophosphamid (CYC) 2 mg/kg KG/d. Alternativ zu CYC bei nicht organ- oder lebensbedrohlichen Verläufen, insbesondere ohne relevante Nierenfunktionseinschränkung kann als Remissionsinduktion Methotrexat (MTX) 10-25 mg/Woche gegeben werden, gefolgt von einer weniger aggressiven Therapie zur Remissionserhaltung (Erhaltungstherapie). Die Glucocorticoide werden je nach klinischem Verlauf und Stabilisierung langsam reduziert; bei Rezidiv erfolgt eine erneute hochdosierte intravenöse oder orale Glucocorticoid-Gabe. Aufgrund der Toxizität wird versucht, CYC nach einem möglichst kurzen Zeitraum von 3-6 Monaten bei Erreichen der Remission, spätestens nach insgesamt 6-12 Monaten, durch Azathioprin oder MTX zu ersetzen. Zur Rezidivprophylaxe bei Morbus Wegener zeigt Azathioprin verglichen mit CYC keine signifikant erhöhte Rezidivrate.
Zum Effekt der Plasmapherese ist die Datenlage uneinheitlich. Sie kann eingesetzt werden bei Patienten mit Kryoglobulinämie oder Hepatitis-B-assoziierter therapierefraktärer Vaskulitis.
Zur Therapie der NSVN gibt es keine Studien. Eine Monotherapie mit Glucocorticoiden kann ausreichend sein. Kommt es unter Monotherapie zu einer Progression der Neuropathie, kann zusätzlich CYC gegeben werden. Treten über einen Zeitraum von 3 Monaten keine zusätzlichen Nervenläsionen auf und sind die sensomotorischen Defizite rückläufig, kann die CYC-Dosis langsam reduziert und ausgeschlichen werden. Auch die Glucocorticoid-Dosis wird langsam reduziert, aber in niedriger Dosis als Rezidivprophylaxe über mindestens 12 Monate beibehalten. Zur Reduktion und Einsparung des Glucocorticoids kann ein zweites immunmodulierendes Medikament eingesetzt werden (Azathioprin; Methotrexat).
Bei Patienten mit einer Arteritis temporalis führt die Glucocorticoid-Monotherapie meist zu einer Remission. Bei einigen Patienten mit vaskulitischer Neuropathie bei Kollagenose kann eine Glucocorticoid-Monotherapie ausreichen, abhängig von Ausmaß und Schweregrad der Nerven-Beteiligung.
Hochdosierte intravenöse Immunglobulin-Gabe stellt eine Therapieoption in Kombination mit der oben genannten Basistherapie (Glucocorticoide, Immunsuppressiva) dar mit guter Wirksamkeit bei 45-75% der Patienten, wie vorläufige Studien bei ANCA-assoziierter Vaskulitis gezeigt haben (Gross 2000).
Begleitmaßnahmen unter immunsuppressiver Therapie
Bei hochdosierter und längerfristiger Glucocorticoid-Gabe sollten eine Osteoporose-Prophylaxe erfolgen und Kontrolle von Blutzucker und Elektrolyten. Unter Immunsuppressiva-Einnahme sind regelmäßige Kontrolle (initial engmaschig) von Blutbild, Leber- und Nierenwerten und Lipase erforderlich. Bei gehäuftem Auftreten einer hämorrhagischen Zystitis unter CYC ist ein Blasenschutz mit (Uromitexan) angezeigt.
Informationsblätter zur Therapie mit Immunsuppressiva stehen für Ärzte und Patienten zur Verfügung.
Weitere Therapieansätze
Der Einsatz weiterer und neuerer Immunsuppressiva wie Cyclosporin A, Mycophenolatmofetil und Leflunomid ist noch nicht ausreichend untersucht. Zum Effekt des Tumor-Nekrose-Faktor Antagonisten Etanercept gibt es widersprüchliche Daten.
Die Behandlung von Gefäßokklusion/vaskuläre Risikofaktoren sollte berücksichtigt werden in der Therapie von Patienten mit Vaskulitis. Das bedeutet eine optimale Einstellung von Diabetes mellitus, arterieller Hypertonie, Hyperlipidämie und eine Nikotinkarenz. Die Gabe von Thrombozytenaggregationshemmer und ggf. Vasodilatatoren kann sinnvoll sein, insbesondere bei Progression der Erkrankung unter adäquater Immunsuppression.
Die symptomatische Therapie besteht in Krankengymnastik, Versorgung mit Hilfsmitteln (z. B. Peronäusschienen, Gehstützen) sowie adäquater Schmerztherapie, z.B. Antidepressiva, Antikonvulsiva.
Prognose
Unter Standardtherapie (Glucocorticoide und/oder immunsuppressive Substanzen) kommt es zu einer Besserung der neurologischen Defizite bei einem Großteil der Patienten mit systemischer und nichtsystemischer Vaskulitis. Unbehandelt liegt die 5-Jahres-Überlebensrate bei Patienten mit systemischer Vaskulitis unter 15 %. Eine bessere Prognose weist die NSVN auf, da hier lebensbedrohliche Komplikationen fehlen und meist eine langsame Progression vorliegt. Die NSVN kann in eine systemische Vaskulitis übergehen.
Trotz verbesserter Therapiemöglichkeiten ist die allgemeine Mortalitität gegenüber der Normalbevölkerung erhöht: bei Patienten mit systemischer Vaskulitis um 12-17%, bei Patienten mit NSVN um 10%.
Sensible Defizite bestehen länger als die motorischen. Es kann lange dauern, dis unter Therapie eine Besserung der neurologischen Defizite eintritt; bis zu einem Jahr nach Therapiebeginn.
