Therapie bösartiger Schilddrüsenerkrankungen
Daten zum Schilddrüsenkarzinom
Das Schilddrüsenkarzinom ist der häufigste von endokrinen Drüsen ausgehende bösartige Tumor, wobei es jedoch bei einem Anteil von ca. 1 % an allen bösartigen Tumoren insgesamt eher selten ist. In Deutschland beträgt die jährliche Inzidenz des Schilddrüsenkarzinoms ca. 3 - 5 Neuerkrankungen pro 100.000 Einwohner. Die Mortalität beträgt ca. 3 - 6/ 1 Mio. E/ Jahr (~ 0.0005%).
Frauen sind etwa doppelt so häufig betroffen wie Männer, die Inzidenz steigt mit zunehmendem Lebensalter deutlich an.
Histologisch unterscheidet man die sog. differenzierten Karzinome (papillär und follikulär) von den undifferenzierten (anaplastischen) und den von den parafollikulären C-Zellen ausgehenden medullären Karzinomen (C-Zell-Karzinom). Das häufigste Karzinom ist das papilläre mit ca. 65 %, gefolgt von den follikulären mit ca. 27 %. Medulläre Karzinome und anaplastische Karzinome sind mit weniger als 5 % deutlich seltener.
Papilläre und follikuläre Schilddrüsenkarzinome treten in der Regel sporadisch auf, allerdings werden familiäre Formen in etwa 5 % der Fälle beschrieben. Im Gegensatz hierzu tritt das medulläre Karzinom familiär gehäuft auf (ca. 25 - 30 %), es wird autosomal dominant mit einer nahezu 100 %igen Penetranz vererbt. Die Ursache ist eine Mutation des sog. RET-Protoonkogens auf dem Chromosom 10. Wiederum die Hälfte dieser Patienten mit der familiären Form des C-Zell-Karzinoms entwickeln im Rahmen der sog. multiplen endokrinen Adenomatose (MEA bzw. MEN) Phäochromozytome (Tumore des Nebennierenmarks).
Als Ursache für die Entstehung von Schilddrüsenkarzinomen gibt es keine gesicherten Faktoren mit einer einzigen Ausnahme, nämlich die Einwirkung ionisierender Strahlung, insbesondere im Kindesalter. Dazu gehört z.B. eine externe Strahlenexposition im Rahmen einer Strahlentherapie oder die Inkorporation von radioaktivem Jod. Dies wird in eindrucksvoller Weise dokumentiert durch den massiven Anstieg der Inzidenz des Schilddrüsenkarzinoms bei Kindern nach der Reaktorkatastrophe von Tschernobyl 1986.
Behandlung des Schilddrüsenkarzinoms
Die Behandlung des Schilddrüsenkarzinoms an der Ludwig Maximilians-Universität München erfolgt interdisziplinär und orientiert sich an den Leitlinien der Deutschen Gesellschaft für Nuklearmedizin, der Deutschen Krebsgesellschaft, der Deutschen Gesellschaft für Endokrinologie (Sektion Schilddrüse) und der Deutschen Gesellschaft für Chirurgie. Die Therapie besteht regelhaft aus 3 Säulen, nämlich der Operation, der Radioiodtherapie und der lebenslänglichen Substitution mit Schilddrüsenhormon.
Die Primärtherapie ist immer chirurgisch, wobei bei den papillären und follikulären Karzinomen die totale Thyreoidektomie (= totale Entfernung der Schilddrüse) die erste Wahl ist.
Radioiodtherapie
Der OP folgt in fast allen Fällen die ablative Radioiodtherapie, deren Aufgabe es ist (üblicherweise gutartiges) Restschilddrüsengewebe bzw. möglicherweise vorhandene Tumorzellen auszuschalten. Hintergrund der Radioiodtherapie ist, dass die Mehrzahl der gut differenzierten SD-Karzinome einen mehr oder weniger stark ausgeprägten Jodstoffwechsel zeigen.
Des weiteren ist die Radioiodtherapie indiziert zur Therapie von Lokalrezidiven, Lymphknoten- und Fernmetastasen, falls die chirurgischen Optionen ausgeschöpft sind.
Der Sinn der postoperativen Radioiodtherapie ergibt sich aus folgenden Überlegungen:
Die Radioiodtherapie führt zu einer Minderung des Rezidivrisikos, vermutlich durch die Zerstörung okkulter Mikrometastasen.
Nur nach primärer ablativer RIT ist in einer Ganzkörperszintigraphie ein sicherer Nachweis bzw. Ausschluß von radioiodspeichernden Metastasen möglich, da noch vorhandenes normales Schilddrüsengewebe stark Iod-avid ist.
Der Tumormarker Thyreoglobulin (hTG) hat bei fehlendem normalem Schilddrüsengewebe sehr viel bessere diagnostische Aussagekraft.
Die Radioiodtherapie wird mit radioaktivem Jod-131 urchgeführt, welches in der Regel in Form einer Kapsel oral verabreicht wird und über den Magen und das Blut in die Schilddrüsenzellen gelangt. Die Strahlenwirkung wird überwiegend durch die beim radioaktiven Zerfall entstehende Beta-Strahlung (b-Zerfall) erzielt, welche im Gewebe eine Reichweite von wenigen Millimetern hat. Damit kann eine sehr hohe Strahlenexposition in dem verbliebenen Schilddrüsengewebe erreicht werden. Die gleichzeitig entstehende Gamma-Strahlung ermöglicht im sog. Posttherapieszintigramm die bildliche Darstellung der Aktivitätsverteilung.
Damit das radioaktive Jod bestmöglich in die Schilddrüsenzellen aufgenommen wird, ist es erforderlich, dass zum Zeitpunkt der Therapie eine deutliche Schilddrüsenunterfunktion vorliegt, weil unter diesen Umständen ein in der Hypophyse gebildetes Hormon (TSH) die Schilddrüsenzellen zu einer max. Aufnahme von Jod stimuliert, angestrebt werden TSH-Werte > 30 µU/ml. Diese Unterfunktion wird in der Regel durch eine ca. 3-wöchige Hormonkarenz nach OP erreicht.
Nicht indiziert ist die Durchführung der Radioiodtherapie bei Patienten mit medullärem oder entdifferenziertem (anaplastischem) Schilddrüsenkarzinom. Absolute Kontraindikationen für die Radioiodtherapie sind Gravidität, d.h. ein Ausschluß durch Schwangerschaftstest ist obligat, und Stillperiode. Nach der Radioiodtherapie wird eine Kontrazeption für 6 – 12 Monate empfohlen, um eine ggf. notwendige, erneute Applikation von Radionukliden nicht zu verhindern.
Durchführung der Radioiodtherapie
Vorbereitung: Wegen der erforderlichen hohen TSH-Stimulation muss ca. 4 Wochen vor Radioiodtherapie eine möglicherweise bestehende Schilddrüsenhormonmedikation abgesetzt werden, nach der OP darf bis zum Zeitpunkt der Radioiodtherapie keine Schilddrüsenhormongabe erfolgen. Des weiteren muss auf eine strikte Jodkarenz geachtet werden (keine Kontrastmittelapplikationen, jodarme Diät).
Entsprechend der gesetzlichen Vorgaben kann die Radioiodtherapie in Deutschland nur stationär durchgeführt werden. Im Rahmen des stationären Aufenthalts wird zunächst mit einer geringen Testaktivitätsmenge die Größe des postoperativ verbliebenen Schilddrüsenrests abgeschätzt (Abbildung).
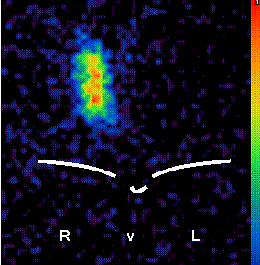 |
| Szintigramm nach einer operativ nahezu entfernten Schilddrüse. |
Bei einem zu großen Schilddrüsenrest muss evtl. in Absprache mit dem Chirurgen eine erneute OP in Betracht gezogen werden. Für die erste Radioiodtherapie werden üblicherweise ca. 3700 MBq (100 mCi) Jod -131 eingesetzt. Am Entlassungstag (üblicherweise 3 Tage nach Gabe der Therapieaktivität) wird mit der im Körper vorhandenen Restaktivität das sog. Posttherapieszintigramm des gesamten Körpers angefertigt (Abbildung). Dieses Szintigramm dient der Überprüfung einer Fernmetastasierung des Schilddrüsenkarzinoms.
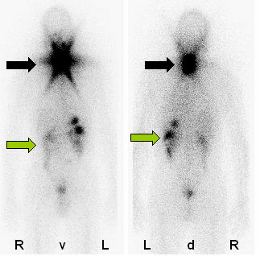 |
| Das Szintigramm nach ablativer Radioiodtherapie zeigt eine deutliche Aktivitätsspeicherung im Bereich der Restschilddrüse (schwarzer Pfeil) und des Magen-Darm-Traktes (grüner Pfeil) aber keinen H.a. eine Metastasierung. |
Ebenfalls am Entlassungstag wird mit der Schilddrüsenhormonsubstitution begonnen, bei der zunächst ein TSH-Wert von < 0,1 µU/ml angestrebt wird. Diese erreicht man in der Regel durch eine Levothyroxin-Dosierung von 2,5 µg/kg Körpergewicht täglich. Bei den prognostisch besonders günstigen papillären Karzinomen mit Größen < 2 cm kann später auf eine komplette TSH-Suppression verzichtet werden, wir empfehlen einen TSH-Zielwert von 0,2 - 0,4 µ/Uml.
Risiken und Nebenwirkungen
Insgesamt sind Nebenwirkungen der Radiojodtherapie selten. Manchmal werden vorübergehende Entzündungen der Schilddrüsen- und Tumorreste, der Speicheldrüsen und der Magenschleimhaut gesehen. Diese Nebenwirkungen sind meist wenig ausgeprägt und können mit entzündungshemmenden Maßnahmen (z.B. Eiskrawatte) bzw. entzündungshemmenden Medikamenten gut behandelt werden. Zur Vermeidung einer Schädigung der Speicheldrüsen ist auf einen ausreichenden Speichelfluss zu achten, was durch Gabe von Zitronensaft, Kaugummi oder sauren Bonbons erreicht werden kann. Des weiteren ist auf eine ausreichende Flüssigkeitszufuhr und häufige Entleerung der Blase zu achten.
Spätschädigungen sind extrem selten und werden nur nach evtl. mehrfach nötiger hochdosierter Radiojodtherapie gesehen. Als späte Nebenwirkungen der Radioiodtherapie werden beschrieben: eine dosisabhängige Knochenmarkinsuffizienz bei einer Gesamtaktivität von meist mehr als 30 - 40 GBq, eine ebenfalls dosisabhängige Leukämieinzidenz (ca. 1 %), das Sicca-Syndrom (Häufigkeit 10 – 20 %) und die Lungenfibrose (< 1 %) bei ausgedehnter Lungenmetastasierung.
Es gibt jedoch keine Hinweise auf ein vermehrtes Auftreten genetischer Schäden, d.h auf auf vermehrte Missbildungen oder andere negative Auswirkungen bei Schwangerschaften nach durchgeführter Radiojodtherapie.
Nachsorge
Obwohl die differenzierten Schilddrüsenkarzinome eine wie beschrieben sehr gute Prognose haben, ist dennoch eine lebenslängliche Nachsorge erforderlich, da es eine Eigenheit der Schilddrüsenkarzinome ist, relativ häufig sog. Spätrezidive zu entwickeln. Ziel der Nachsorge ist somit das frühzeitige Erkennen eines Rezidivs bzw. eine Metastasierung des Schilddrüsenkarzinoms.
Der wichtigste Parameter in der Nachsorge der differenzierten Schilddrüsenkarzinome ist das sog. Thyreoglobulin, eine Substanz, die ausschließlich von Schilddrüsenzellen produziert wird. Nach erfolgreicher Ablation des Restschilddrüsengewebes darf im Blut des Patienten kein Thyreoglobulin nachgewiesen werden. Bei Thyreoglobulinspiegeln unterhalb der Nachweisgrenze erübrigen sich üblicherweise weitergehende morphologische Untersuchungen. Im Rahmen der Nachsorgeuntersuchungen muss des weiteren die ausreichende Substitution durch Schilddrüsenhormone überprüft werden, ebenso der Calciumspiegel und das Blutbild.
Bei einem erneuten Auftreten eines messbaren Thyreoglobulinspiegels müssen z.B. mit einem diagnostischen Jod131-Ganzkörperszintigramm (in Schilddrüsenunterfunktion) oder anderen bildgebenden nuklearmedizinischen Verfahren (in erster Linie Positronenemissionstomographie) sowie röntgenologischen Untersuchungsverfahren (Computertomographie, Kernspintomographie) mögliche Rezidive bzw. Metastasen gesucht werden. In Abhängigkeit dieser Ergebnisse ergeben sich die Therapieoptionen, die im wesentlichen das Spektrum der Erst-Therapie umfassen.
Prognose
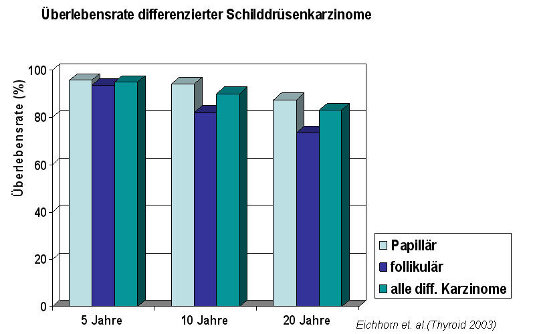
Die Prognose der differenzierten Schilddrüsenkarzinome ist generell sehr gut, die 10-Jahres-Überlebensrate wird für papilläre Karzinome zwischen 85 und 90 %, die für follikuläre Karzinome zwischen 75 und 80 % angegeben. Lokalrezidive sieht man in 5 - 20 % der Fälle, Metastasen in 10 - 15 %. Die Prognose hängt neben dem Tumorstadium und histologischem Typ (Abbildung) vom Patientenalter ab, jüngere Patienten haben eine deutlich bessere Prognose.
Bei erhaltener Jodspeicherung der Tumorzellen besteht selbst bei einer ausgedehnten Metastasierung mit einer hochdosierten Radioiodtherapie eine erfolgreiche Therapieoption (Abbildung)
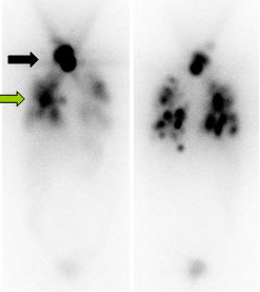 |
| Das Szintigramm nach der ersten ablativen Radioiodtherapie zeigt eine deutliche Aktivitätsspeicherung im Bereich der Restschilddrüse (schwarzer Pfeil) und eine massive Metastasierung in der Lunge (grüner Pfeil). |
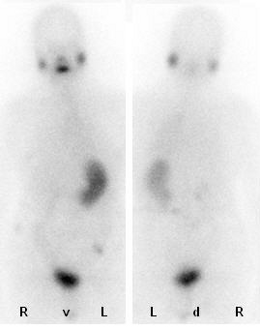 |
| Das Szintigramm zeigt die selbe Patientin nach dem insgesammt drei Radioiodtherapieen durchgeführt wurden. Es ergiebt sich kein H.a. eine weiterhin bestehende Metastasierung, der Tumormarker Thyreoglobulin ist unterhalb der Nachweisgrenze. Man erkennt die physiologische Iodspeicherung in den Speicheldrüsen, Magen-Darm-Trakt und der Harnblase. |
Weiterführende Literatur finden Sie unter:
Tumorzentrum München:
Manual Endokrine Tumoren; Empfehlungen zur Diagnostik, Therapie und Nachsorge. 1. Auflage 2006 (Zuckschwerdt Verlag)
Interdisziplinäre Leitlinie der Deutschen Krebsgesellschaft und der
Deutschen Gesellschaft für Chirurgie. Informationszentrum für Standards
in der Onkologie - ISTO. Maligne Schilddrüsentumoren.
www.uni-duesseldorf.de/AWMF
Verfahrensanweisung zur Radioiodtherapie (RIT) beim differenzierten Schilddrüsenkarzinom (Deutsche Gesellschaft für Nuklearmedizin);
Nuklearmedizin 2004; 43:115 – 20
-
Eichorn W, Tabler H, Lippold R, Lochmann M, Schreckenburger M, Bartenstein P. Prognostic factors determining long-term survival in well-differentiated thyroid cancer: an analysis of four hundred eighty-four patients undergoing therapy and aftercare at the same institution. Thyroid 13 (2003) 949-958.
